Obsah
Organická chemie
- základní stavební prvek je C
- má vždy vaznost 4
- zakladatel Fridrich Wöhler (1828) - tepelným rozkladem připravil z látky anorganické látku organickou
- látky obsahující
- H - uhlovodíky
- O - alkoholy, aldehydy, ketony, fenoly, org. kyseliny, ethery
- N, S, P, Si, halové prvky - halogenidy uhlovodíků (CCl4 - tetrachlor methan, teflon, chloroform, bromoform, bromexin)
- N - dusíkaté deriváty
- S, P, Si, As
Funkční deriváty organických kyselin
Halogenidy
- název se tvoří z názvu acylu s halogenidovým iontem
- štiplavé kapaliny nebo krystalické, většinou reagují adicí s následnou eliminací
- nejčastější reakce s vodou, alkoholy a amoniakem
- formylfluorid H-CO-F
- acetylfluorid CH3-CO-Cl
Anhydridy
- R - (CO) - O - (CO) - R'
- příprava: dehydratací org. kyselin
- acetanhydrid CH3 - (CO) - O - (CO) - CH3
- výroba acetátového hedvábí
- ftalanhydrid - výroba plastů
Estery
- R - COO - R'
- H - COO - CH3 methylester kyseliny mravenčí, mravenčan ethylnatý, methyl formiát
- estery o nižší molekulové hmotnosti - kapaliny příjemné vůně
- vyšší estery - látky krystalické, bez zápachu, dobře rozpustné v org. rozpouštědlech
- výskyt v přírodě - ovoce
- příprava:
- acylace alkoholu
- esterifikací - probíhá pozvolna, reakce vratná
- CH3COOH + C2H5OH → CH3 - COOH - C2H5 + H2O (ethylmethylester, ethylester kys. octové, octan ethylnatý)
- hydrolýza
- kys. i zásadité prostředí
- při alkalické hydrolýze (zmýdelnění) je produktem mýdlo
- mravenčan ethylnatý H - COO - C2H5
- použití - potravinářský průmysl - rumová tresť
- octan ethylnatý CH3 - COO - C2H5
- přírodní tuky a oleje - estery glycerolu a vyšších mastných kyselin
Nitrily
- R - C ≡ N
- kapalné nebo krystalické látky, rozpustné ve vodě, jedovaté
- reakce s vodou - probíhá hydrolýza
- R - C ≡ N + H2O → R - COOH - NH3
- acetonitril CH3 - CN
- rozpouštědlo
- akrylonitril CH2 = CH - CN
- výroba syntetických vláken
- Kyanovodík
- H - C ≡ N
- nejjednodušší nitril
- příprava:
- CO + NH3 → HCN + H2O (katalyzátor: Al2O3; za zvýšené teploty 500° - 700°C)
- bezbarvá kapalina, slabá kyselina
- soli: kyanidy
- prudce jedovaté
- zapáchají po hořkých mandlích
- způsobují ochrnu dýchacích cest
- kyanid draselný - cyankáli; nejprudší jed
- kyanid sodný - galvanické pokovování; nejprudší jed
- součástí komplexů:
- hexakyanoželeznatan draselný: K4[Fe(CN)6]
- hexakyanoželezitan draselný: K3[Fe(CN)6]
- krevní soli
- indikátory, analytická chemie
Kyslíkaté deriváty
Zde ještě plno řádků chybí
Oxidace alkoholů
- produkt oxidace závisí na struktuře alkoholu
- oxidace primárního alkoholu R1-CH2-OH → oxidace → R-CH=O aldehyd
- oxidace sekundárního alkoholu R2-CH-OH → oxidace → R-CO-R keton
- oxidace triciálního alkoholu R3-C-OH - většinou je produkt keton a karboxylová kyselina
např. 2-methyl-2-propanol → oxidace → (aceton) H3C-CO-CH3 + HCOOH (kys. mravenčí)
Oxidace fenolů
- probíhá za přítomnosti peroxidu vodíku jako oxidentu (H2O2), katalizační činidlo s oxidačním číslem +II
např. fenol (hydroxobenzen) → za přítomnosti H202 a Fe+II → vzniká buď pyrokatechol (1,2-dihydroxobenzen) nebo hydochinon (1,4-dihydroxobenzen ···> benzochinon)
- chinony = diketony aromatických uhlovodíků
Příprava alkoholů a fenolů
- alkoholy:
- adicí vodou na alkeny
- kvašením cukerných roztoků
- fenoly:
- oxidace aromatických uhlovodíků
- frakční = postupná destilace dehtu
- reakce s kovy → vznikají alkoholáty a fenoláty
např. Br-CH2-CH2-CH3 + CH3-CH2-CH2-O-Na (=propanolát sodný) → NaBr + CH3-CH2-CH2-O-CH2-CH2-CH3 (=dipropylether)
např. (nevím, kam to patří) glycerol (=1,2,3-propantriol = CH2OH+CHOH+CH2OH) + HNO3 (kys. dusičná) -> nitroglycerin (=glyceroetrinitrát CH2ONO2-CHONO2-CH2ONO2) + 3H20
Sloučeniny
methanol
- CH3-OH
- vzniká oxidací formaldehydu nebo vodního plynu
- CO+H2 → CH3OH
- velmi jedovatá látka
ethanol
- C2H5OH = líh
- použití:
- jako rozpouštědlo (barev, laků)
- výroba lihovin - líh vzniká kvašením roztoků
buthanoly
- rozpouštědla
- ostře páchnoucí látky
glykoly
- výroba špatně mrznoucích směsí
glycerol
- =1,2,3-propantriol
- součást rostlinných olejů a tuků
- příprava: alkaická hydrolýza (vznik mýdel), kyselá hydrolýza (vzniká směs mastných kyselin)
- nitrací vzniká nitroglycerin = glyceroltrinitrát
- použití v lékařství (kardiaci na rozšíření krevcních cév - v tabletách - volně rozpustit pod jazykem)
cyklohexanol
- výroba umělých vláken
fenol
- tuhá krystalická látka
- jedovatý (až karcinogenní)
- výroba fenolplastů
pyrokatechol
- silné redukční účinky
- součíst vývojky v černobílé fotografii
naftoly
- výroba barviv
Organické deriváty anorganických kyselin
- deriváty H2CO3
- fosgen O = C - Cl2
- kys. karbamová O =C -OH, NH2
- soli - karbamany
- estery - uretany
- polyuretany - výroba plastických hmot
- diamid kys. uhličité
- močovina
- O = C - NH2, NH2
- NH3 + CO2 → O = C - NH2, NH2 +H2O
- 1928 Fridrich Wohler
- NH4CNO → O = C - NH2, NH2
- bezbarvá krystalická látka, rozpustná ve vodě a alkoholu
- zahříváním vzniká biuret
- analytická chemie
- k důkazům mědi
- výroba plastů, pryskyřice, hnojiv, hypnotika
- thiomočovina
- S - C - NH2, NH2
- deriváty H2SO4
- O,O = S - OH, OH
- jednu OH skupinu můžeme nahradit alkylem nebo arylem ⇒ alifatická nebo aromatická látka
- sulfo- skupina je HSO3
- C6H5CO3H = kys. benzensulfonová (=sulfonbenzen); příprava sulfonací = reakce aromátu s H2SO4
- trisulfobenzoová kyselina (=trisulfobenzen) - rozpustná v H2O, silná kyselina
------HSO3
/ \
HSO3_/ O \
\ /
\ /
------HSO3
- aminobenzensulfonová kyselina = sulfanilová kyselina - součást hnojiv a léčiv
- amid kys. sulfanilové = sulfanilamid se použává při alergických reakcích na antibiotika
Reakce v OCH
Základní typy reakcí
Adice
- reakce, kdy dochází ke štěpení násobné vazby a navázání substituentů
- chlorace, hydrogenace
Eliminace
- opak adice
- dehydrogenace, dehydratace, dehalogenace
Substituce
- R - X + OH- → R - OH + X-
- R - radikál, X - halový prvek
Esterifikace
- reaguje kyselina a alkohol, vzniká sůl kyseliny a H2O
Přesmyk
Dělení reakcí podle štěpení kovalentních vazeb
- Štěpení symetrické (=homolitické)
- každý z vázaných atomů si ponechá 1 elektron
- reakce se označují jako radikálové
- Štěpení asymetrické (=heterolitické)
- reakce iontové
- jeden z atomů si ponechá všechny elektrony
Organická činidla
- Radikálová (=substituční)
- halové prvky (Cl-, Br-…)
- radikály (= substituenty) - CH3- (methyl)
- Iontová
- nukleofilní
- váží se na místa s nedostatkem elektronů
- elektrofilní
- váží se na místa s nadbytkem elektronů
Substituční deriváty organických kyselin
- substituce postranního řetězce substituentem (prvek nebo funkční skupina)
- substituent označen jako X
- X = OH - hydroxykarboxylové kyseliny
- X = hal. prvek - halogenkarboxylové kyseliny
- X = NH2 - aminokarboxylové kyseliny (aminokyseliny)
- X = COH - aldehydkarboxylové kyseliny (aldokyseliny)
- X = CO - R - ketokarboxylové kyseliny
Halogenkarboxylové kyseliny
- příprava: přímá halogenace org. kyselin
kys. fluoroctová
- CH2F - COOH
- prudce jedovatá
- výskyt v tropických rostlinách
kys. trichloroctová
- CCl3 - COOH
- koncentrovaná - leptavé účinky
- nízká koncentrace - kožní lékařství
Hydroxykarboxylové kyseliny
- vlastnosti kyselin a alkoholů
- sirupovité kapaliny nebo krystalické látky
- zahříváním odštěpují vodu
- příprava: hydrolýza halogenkyselin, oxidací dvojsytných nebo trojsytných alkoholů (oxidovadlo - HNO3)
- CH2OH-CHOH-CH2OH + HNO3→CH2OH-CHOH-COOH + H2O
kys. mléčná
- CH3- CHOH - COOH
- vzniká mléčným kvašením sacharidů
- výskyt v mléčných výrobcích (př. kyselé mléko,…), rychlokvašené okurky
- reakcí s H2S04 vzniká acetaldehyd, CO2 (popř. CO), SO2
- použití: kožařský průmysl
kys. jablečná (kys. hydroxyjantarová)
- COOH - CHOH - CH2 - COOH
- v nezralém ovoci
- meziprodukt v metabolismu rostlin
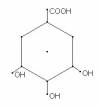
kys. vinná (kys. dihydroxyjantarová)
- COOH - CHOH - CHOH - COOH
- soli: vínany
- použití: analytická chemie
kys. citrónová
CH3- COOH
|
OH - C - COOH
|
CH3-COOH
- trojsytná kyselina
- výskyt: citrusové plody, rybíz, brusinky, borůvky
- syntetická výroba - zkvašování cukrů pomocí bakterie Aspergillus niger
- použití: potravinářský průmysl, stabilizátor - barvení tkanin, konzervace krve
kys. salicylová
- bakteriostatické účinky (= brzdí růst mikroorganismů)
- deriváty
- kys. acetylsalicylová (acylpyrin) - antipyretikum (prostředek ke snížení teploty a horečky)
- fenylester kys. salicylové - antiseptické účinky, dezinfekční látka při onemocnění močových cest
kys. gallová (kys. trihydroxybenzoová)
- obsažena hlavně v dubové kůře
- součastí tříslovin (př. tanin)
- zásaditá bismutitá sůl - dermatol (použití - kožní lékařství)
Aldo- a keto- kyseliny
kys. pyrohroznová
- CH3 - CO - COOH
kys. acetoctová
- CH3 - CO - CH2 - COOH
- obě tyto kyseliny - biochemické procesy v organismu
Kromě míst, kde je explicitně uvedeno jinak, je obsah této wiki licencován pod následující licencí:GNU Free Documentation License 1.3